Разработана 3D-модель живого рака мозга, которая может помочь в создании новых методов лечения
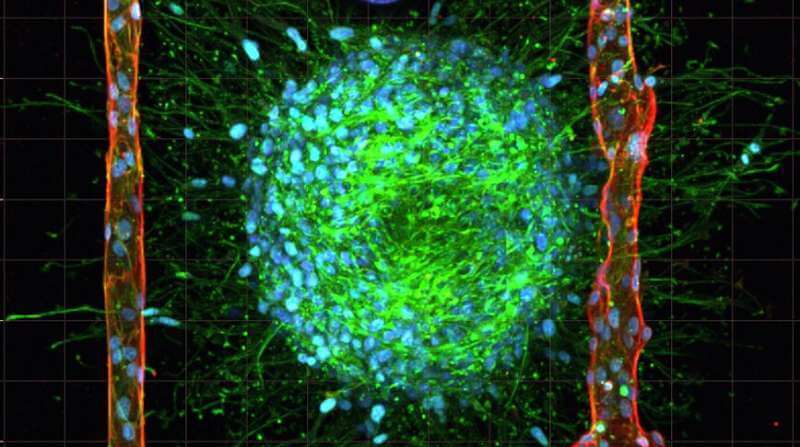
В качестве потенциальной альтернативы для тестирования лекарств без лабораторных животных исследователи из Королевского технологического института KTH разработали и успешно испытали 3D-модель живого рака мозга, которая преодолевает одну из самых больших проблем в тканевой инженерии.
В недавнем выпуске научного журнала "Advanced Materials" исследователи сообщили о методике воспроизведения мельчайших кровеносных сосудов организма, известных как микрососуды, внутри коллагенового гидрогеля с живыми раковыми клетками. Этот метод, который называется кавитационным формованием, создает полости достаточно маленькие, чтобы клетки могли сформироваться в кровеносные сосуды в масштабе, более близком к человеческому телу.
Ведущий автор исследования, Алессандро Энрико, аспирант KTH, говорит, что техника создания полостей для кровеносных сосудов представляет собой прорыв в биомедицинских исследованиях, и что этот метод потенциально может быть использован для моделирования других видов человеческих тканей, помимо раковых.
"Это исследование представляет собой большой шаг вперед в плане создания тканеинженерной модели для скрининга лекарств", - говорит Энрико.
Для разработки лекарств единственной альтернативой испытаниям на животных являются простые двухмерные клеточные модели, в которых человеческие клетки культивируются на пластике в плоском, двухмерном расположении. Он говорит, что хотя платформы "лаборатория-на-чипе" в 2D используются для воспроизведения живой ткани, они в конечном итоге ограничены своей простотой.
"2D модели тканей замедляют процесс тестирования и делают его более дорогостоящим", - говорит он. "Результаты работы с 3D-моделью относятся к реальной трехмерной ткани в человеческом теле".
По его словам, тиражирование 3D-модели ткани позволит преодолеть разрыв между простыми 2D-моделями и реальной физиологией тканей.
"Но получить трехмерную микрососудистую сеть в гидрогелевом скаффолде при сохранении жизнеспособности клеток - задача не из легких".
Чтобы создать микрососуды, которые необходимы для выживания сложных тканей, таких как живой рак мозга, исследователи начали с литья неструктурированного коллагенового гидрогеля, содержащего живые раковые клетки. Затем они использовали лазерное облучение гидрогеля для создания пузырьков газа, которые перестраивают коллагеновые волокна, создавая тем самым полости и формируя микроканалы. Наконец, эндотелиальные клетки закачиваются в полости, после чего они собираются в искусственные кровеносные сосуды, схожие по размеру с сосудистой сетью человеческого организма.
Этот процесс не приводит к повреждению клеток, что является реальным риском при использовании методов биопечати, находящихся в стадии разработки.
3D модели тканей в точности повторяют живые ткани и остаются стабильными в физиологических условиях не менее восьми дней. "Это очень важно для изучения сложных биологических взаимодействий, на развитие которых могут уйти дни или недели", - говорит Энрико. Энрико говорит, что следующим шагом будет изучение совместимости этого метода с другими гидрогелями для моделирования различных тканей и органов.